ЗЗАСЕДАНИЕ № 528
СОСТОИТСЯ В
ЧЕТВЕРГ, 25 МАЯ 2006
г., в 17. 00
В
КОНФЕРЕНЦ-ЗАЛЕ РОССИЙСКОГО ОНКОЛОГИЧЕСКОГО НАУЧНОГО ЦЕНТРА им.Н.Н.БЛОХИНА
Председатели: проф. А.И. Пачес,
проф. А.А. Клименков,
проф. И.С. Стилиди
ПОВЕСТКА ДНЯ:
ХИРУРГИЯ НЕОРГАННЫХ
ЗАБРЮШИННЫХ ОПУХОЛЕЙ
Демонстрация: ДЛИТЕЛЬНОЕ НАБЛЮДЕНИЕ ПОСЛЕ УДАЛЕНИЯ ЗАБРЮШИННОЙ
НЕОРГАННОЙ ЛЕЙОМИОСАРКОМЫ С
ПРОТЕЗИРОВАНИЕМ ПОДВЗДОШНЫХ
АРТЕРИИ И ВЕНЫ
Неред С.Н., Дан В.Н*, Стилиди И.С., Губина Г.И., Клименков А.А., Синюкова Г.Т., Аллахвердиева Г.Ф.
(Российский онкологический научный центр им. Н.Н. Блохина, *Институт хирургии им. А.В.Вишневского)
 Больная
И., 58 лет, оперирована в РОНЦ (24.06.1997) по поводу неорганной
забрюшинной лейомиосаркомы тазовой локализации.
Опухоль размерами 7х5х5 см врастала в левые общие и наружные подвздошные
артерии и вены. Опухоль иссечена с резекцией указанных сосудов. Выполнена
пластика подвздошно-бедренных сегментов артерии и вены с использованием протезов GorTexÔ,
длиной 12 см.
Больная
И., 58 лет, оперирована в РОНЦ (24.06.1997) по поводу неорганной
забрюшинной лейомиосаркомы тазовой локализации.
Опухоль размерами 7х5х5 см врастала в левые общие и наружные подвздошные
артерии и вены. Опухоль иссечена с резекцией указанных сосудов. Выполнена
пластика подвздошно-бедренных сегментов артерии и вены с использованием протезов GorTexÔ,
длиной 12 см.
При
контрольных обследованиях в РОНЦ в течение  последующих
лет 9 лет прогрессирования опухоли и
признаков венозной недостаточности в нижних
конечностях не выявлено.
последующих
лет 9 лет прогрессирования опухоли и
признаков венозной недостаточности в нижних
конечностях не выявлено.
![]() Тазовая
флебо-
и ангиография (23.03.2000): венозный и артериальный сосудистые протезы
полностью проходимы. Данных за венозный пристеночный тромбоз не получено (рис).
Тазовая
флебо-
и ангиография (23.03.2000): венозный и артериальный сосудистые протезы
полностью проходимы. Данных за венозный пристеночный тромбоз не получено (рис).
При УЗИ с доплексным сканированием (12.05.2006) подвздошные и бедренные артерии и вены проходимы с обеих сторон без признаков окклюзии и тромбоза.
Цель демонстрации: Показать возможность
протезирования венозных магистральных сосудов с сохранением адекватного
кровотока в течение длительного времени у больных неорганными забрюшинными опухолями.
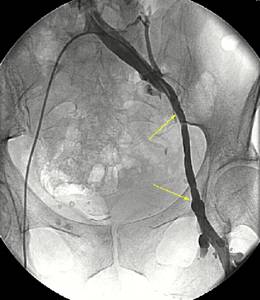
Рис. Бедренно-подвздошная
флебография через 3 года после операции. Венозный сосудистый протез (указан
стрелками) полностью проходим.
Доклад: НЕПОСРЕДСТВЕННЫЕ РЕЗУЛЬТАТЫ
ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ
НЕОРГАННЫХ ЗАБРЮШИННЫХ ОПУХОЛЕЙ
Стилиди И.С., Губина Г.И., Неред С.Н., Клименков А.А., Сельчук В.Ю.,
Тюрин И.Е., Меликов С.А., Болотский В.И., Какиашвили Н.Н.
(Российский
онкологический научный центр им. Н.Н. Блохина)
В понятие неорганных
забрюшинных опухолей (НЗО) объединяются
новообразования, располагающиеся в собственно забрюшинном пространстве,
между брюшинными листками брыжеек кишечника, подбрюшинно
в полости таза и не имеющие оргàнной
принадлежности.
Редкостью данной патологии (частота НЗО не превышает 1% всех новообразований
человека) объясняется тот факт, что только немногие клиники имеют убедительный многолетний опыт лечения
подобных больных. Среди них – отделение абдоминальной онкологии НИИ КО РОНЦ им.
Н. Н. Блохина РАМН, где наблюдалось более 800 больных.
В основу данного сообщения положен анализ результатов 142 оперативных
вмешательств, выполненных в период 2000-2005 гг. В 26 (18,3%) случаях операции произведены
по поводу доброкачественных, а в 116 –(81,7%) злокачественных опухолей.
Изучение морфологических вариантов НЗО подтверждает данные литературы о их большом разнообразии и явном преобладании (85; 59,9%) новообразований
мезодермального происхождения, в первую очередь, жировой природы – 58
(40,8%) наблюдений. Затем следуют
нейрогенные опухоли – 33 случая (23,2%).
Распределение больных по полу и
возрасту свидетельствует об одинаковой частоте НЗО у лиц мужского и женского
пола (63 и 79 человек соответственно). Подавляющее большинство пациентов находились
в возрасте до 60 лет – 118 (83,1%). При этом в группе больных с рецидивами НЗО
превалировали более молодые люди (средний возраст –
43,7 лет по сравнению с 56,0 при
первичных опухолях). Этот факт – развитие НЗО, главным образом, у пациентов
трудоспособного возраста, придает данной проблеме особую социально-экономическую
значимость.
При изучении местной распространенности НЗО установлено, что из 58
больных липосаркомами лишь у 5 (8,6%) опухоль
занимала одну анатомическую зону, у 17 (29,3%) – две и у 36 (62,1%) – три и более. Размер новообразования в наибольшем измерении в
среднем составил 20,2 см. При опухолях
иной гистологической структуры поражение только одной анатомической зоны
имелось в 53 случаях из 84 (63,1%). Но у 31 больного из них (58,5%) были НЗО
тазовой локализации. Размер опухоли в наибольшем измерении в среднем составил
10,1 см.
Приведенные данные убедительно свидетельствуют
о том, что в клинике концентрируются больные с местнораспространенным
опухолевым процессом. В подобной ситуации, исходя из того, что альтернативы хирургическому
лечению при НЗО до настоящего времени не существует, становится
очевидным сколь большое внимание нами уделяется методам уточняющей диагностики.
Диагностический комплекс включает физикальные, лабораторные, общеклинические
инструментальные и специальные методы исследования. Именно последним (различные
модификации ультразвукового исследования, рентгеновская компьютерная
томография, магнито-резонансная
томография, ангиография, многослойная компьютерная томография с болюсным усилением и последующей трехмерной реконструкцией)
отводится главная роль в оценке локализации опухоли и ее взаимоотношений с
предлежащими органами, сосудами и иными структурами.
Полученная при обследовании информации должна быть достаточной не только для решения вопроса о резектабельности опухоли, но и для построения плана
предстоящей операции (оперативный доступ, предполагаемый объем, вероятность
возможных осложнений), оценки соматического состояния пациента (в смысле переносимости им
планируемого оперативного вмешательства), а также возможности должного реанимационно-анестезиологического
обеспечения самой операции.
Оперированы по поводу первичной опухоли 94 (66,2%), в
связи с рецидивом – 48 (33,8%) больных.
В первой группе радикальные вмешательства выполнены 79 (84,4%), паллиативные – 10
(10,6%), эксплоративные – 5 (5,3%) больным.
При рецидиве НЗО существенно
увеличивается доля паллиативных операций – 43,8% и почти в два раза чаще выполняются
эксплоративные лапаротомии – 10,4%. Лишь в 43,75% (у 21 больного) оказалась
возможной радикальная операция.
Отмечается явная зависимость количества радикальных операций от
порядкового номера рецидива. Если при
первом рецидиве нам удалось
радикально удалить опухоль в 54,6% случаев, при втором – в 40%, то при третьем и более – только у 10,0%
больных.
Из 132 больных резектабельными
новообразованиями 64 (48,5%) выполнено комбинированное оперативное
вмешательство. Если для удаления
первичной опухоли подобное расширение объема операции потребовалось в 37 случаях из 89 (41,6%), то
при рецидиве НЗО – в 27 из 43 (62,8%). У 64 больных дополнительно удалено или
резецировано 115 органов. Наиболее часто производились нефрэктомия
(39,1%), спленэктомия (34,4%), резекция различных
отделов желудочно-кишечного тракта (29,7%), резекция поджелудочной железы
(14,1%) и т.д. В подавляющем большинстве случаев выполнение подобных
вмешательств было продиктовано
онкологическими соображениями.
Резекция магистральных сосудов с последующим протезированием произведена 5 больным (в 4 случаях – подвздошной артерии и в 1 –
нижней полой вены).
Интраоперационные осложнения возникли
у 21,1 % больных. В 15 случаях развилось кровотечение
(ранение магистрального сосуда (4), кровотечение из пресакрального
венозного сплетения (6), диффузное кровотечение из ложа опухоли (5), еще в 15 – отмечена травма полого или паренхиматозного
органа (нарушение целостности стенки кишки (5), стенки мочеточника (2), вскрытие
просвета мочевого пузыря (1); ранение печени
(1), травма капсулы селезенки (6).
В послеоперационном периоде осложнения,
непосредственно связанные с самой операцией, развились у 30 больных (22,7%):
кровотечения (11; в 5 случаях приведшие к летальному исходу), абсцесс в ложе
удаленной опухоли (5), панкреатит (4), некроз стенки полого органа – (4; в 2 случаях приведшие к летальному исходу),
спаечная тонкокишечная непроходимость (2), наружный тонкокишечный свищ (2),
тромбоз наружней подвздошной вены (2).
Причиной еще двух летальных исходов стали
тромбоэмболия легочной артерии и сепсис на фоне гнойного пиелонефрита,
вызванного мультирезистентной микрофлорой.
Вероятность возникновения осложнений находится в прямой зависимости от
объема оперативного вмешательства. Осложненное течение послеоперационного
периода после вмешательств обычного объема отмечено в 13 случаях из 68
(19,1%), при комбинированных операциях –
в 17 из 64 (26,6%).
Показатель послеоперационной летальности существенно различался в группах больных первичными и рецидивными НЗО, а также зависел от характера операции.
После радикального удаления первичной НЗО умерли 2 (2,5%) из 79
больных, после паллиативного – 1 из 10 (10%). Необходимо отметить, что если из
26 больных с первичной НЗО тазовой локализации в послеоперационном периоде
умерли 3 (11,5%), то при внутрибрюшном расположении опухоли (63 наблюдения)
послеоперационных летальных исходов не было. В целом, показатель
послеоперационной летальности составил в группе больных первичными
НЗО 3,4%.
После радикального удаления
рецидива в послеоперационном периоде умер 1 (4,8%) из 21 оперированного, после паллиативных операций – 5 (22,7%) из 22;
общая летальность после операций по поводу рецидивов составила 14,0%.
Приведенные данные вполне объяснимы, если помнить об особенностях опухолевого процесса у оперированных. Практически у всех больных имелись местнораспространенные опухоли, потребовавшие выполнения обширных, травматичных операций.
Анализ успехов и неудач позволил установить ряд ключевых моментов, имеющих принципиальное значение для исхода любого оперативного вмешательства по поводу неорганных забрюшинных опухолей:
1) Хирургический доступ. Считаем, что доступом
выбора при НЗО является срединная
лапаротомия, позволяющая провести полноценную ревизию брюшной полости, оценить
расположение опухоли и ее взаимоотношения с окружающими структурами,
обеспечить подход к магистральным
сосудам для их возможного пережатия
(перевязки) на протяжении, обеспечивает визульный
контроль окружающих опухоль органов, создает достаточную ширину зоны
операционного действия для удобства манипулирования в глубине раны. При массивных новообразованиях малого таза возможна комбинация лапаротомного
доступа с промежностным, либо применение разработанного в нашей клинике
(Ибрагимов Т.Ф., 2003 г.) чрезбрюшинного
подвздошно-пахового доступа. Местнораспространенные
опухоли верхних отделов забрюшинного пространства в
ряде случаев требуют применения торако – френо-лапаротомии.
2) Особенности мобилизации. Обязательной является последовательность и методичность
всех действий хирурга, работа «от
сосудов», по межфасциальным пространствам, острым
путем, при постоянном визуальном контроле предлежащих анатомических образований.
Необходимо стремиться к экстракапсулярному выделению опухоли в едином блоке с окружающей
клетчаткой, дополняя его резекцией или удалением органа, вовлеченного в процесс
вторично.
3) Адекватность дренирования. На завершающем этапе операции во всех случаях
производится дренирование зоны операции – как с целью контроля
за гемостазом, так и профилактики развития абсцесса, учитывая наличие большой сецернирующей
поверхности.
4) Устранение осложнений.
Тактические приемы при возникновении интраоперационного осложнения определяются
характером последнего. При ранении полого органа они хорошо
известны. Подчеркнем лишь, что при травме мочеточника должна быть
предпринята попытка ушивания дефекта с
последующим стентированием или же формированием уретероцистанастомоза. Наиболее сложной проблемой является
борьба с кровотечениями. Травма
магистрального сосуда, как правило, создает
меньшие проблемы для хирурга, чем
кровотечение из пресакральных венозных
сплетений или диффузное кровотечение из ложа опухоли. В первом случае, как правило, дефект ушивается после предварительного отжатия сосуда. Во
втором – использование прошивания,
электрокоагуляции, гемостатических
материалов, несмотря на ранее произведенную перевязку внутренних подвздошных
артерий, нередко мало эффективно. В данной ситуации необходимо прибегать к тугой тампонаде данной зоны. Весь этот
арсенал средств должен использоваться на фоне адекватной реанимационно-анестезиологической
поддержки, включая применение аппарата для аутотрансфузий эритроцитов «Sellsaver».
В заключение необходимо
отметить, что при неорганных
забрюшинных опухолях не существует стандартных оперативных вмешательств.
Любое из них, особенно при местнораспространенных
опухолях, сопряжено с возможностью осложнений. Хирургическая бригада,
выполняющая подобную операцию, должна в равной мере владеть навыками работы на
всех органах брюшной полости и забрюшинного
пространства, на сосудах. Данные операции возможны только при наличии
высокопрофессиональной реанимационно-анестезиологической службы и адекватного
материально-технического обеспечения.
Улучшение непосредственных результатов хирургического лечения НЗО связывается
с ранним выявлением этих новообразований, внедрением в амбулаторную диагностику
ультразвуковых исследований как обязательного компонента обследования
любого пациента, а тем более – уже
оперированного по поводу НЗО, при должной настороженности и квалификации специалистов.
Дискуссия. Фиксированные выступления в прениях:
¨ Особенности послеоперационного ведения онкологических больных,
перенесших острую массивную интраоперационную кровопотерю. Ломидзе С.В., Свиридова С.П., Мазурина О.Г. (отделение реанимации и
интенсивной терапии РОНЦ им. Н.Н. Блохина).
В 1995-1997 гг. в ОРИТ РОНЦ наблюдались 110 пациентов, перенесших острую массивную интраоперационную кровопотерю (порядка 60-500% ОЦК). Летальность составила 13,5%: 10 (9%) больных умерли в раннем послеоперационном периоде по причине гиповолемического шока и острого ДВС-синдрома, 5 (4,5%) – в поздние послеоперационные сроки на фоне развившихся гнойно-септических осложнений. В последующие годы, несмотря на возрастание числа операций, осложненных массивными кровопотерями (в 2003 г. – 213, в 2004 г. − 233, а в 2005 г. − 299), ранняя послеоперационная летальность, напротив, существенно снизилась. В 2003 г. от гиповолемического шока и острого ДВС-синдрома на фоне продолжающегося кровотечения умерли 2 (1%) больных, в 2004 г. – 1 (0,4 %), в 2005 г. − 3 (1%) больных. Поздняя послеоперационная летальность по причине септического шока или тяжелого сепсиса, развившихся на фоне гнойно-септических осложнений составила в 2003-2005 гг. 4,0; 3,4; 5,7 % соответственно.
Специфика онкологических операций, прежде всего –
комбинированно-расширенных, выполняемых по поводу местнораспространенных
опухолевых поражений, сопряженных с большой операционной травмой и, что очень
важно, массивным цитолизом (следствие выполнения обширных лимфодиссекций),
проявляется, в том числе, частым развитием осложнений – как во время хирургических вмешательств, так и в раннем послеоперационном периоде. При этом
массивные интраоперационные кровопотери приводят к
таким последствиям, как гиповолемический шок, острый ДВС-синдром, гемодилюционная коагулопатия, синдром системной воспалительной реакции,
ОРДС, полиорганная недостаточность.
Опыт
интенсивной терапии онкологических больных, перенесших операции, осложненные массивной
кровопотерей, в том числе у больных пожилого возраста и с тяжелой сопутствующей
патологией, позволил определить общие принципиальные положения по ведению
раннего послеоперационного периода.
Состояние системной
гемодинамики и гемостаза как во время оперативных
вмешательств, так и в раннем послеоперационном периоде напрямую зависят от
объема и качественного состава инфузионно-трансфузионной
терапии (ИТТ). Сложность построения ИТТ заключается не только в необходимости
восполнять дефицит ОЦК, но и в стремлении поддерживать в организме адекватный
баланс жидкости, чтобы избежать опасной, особенно для раннего
послеоперационного периода, гипергидратации,
способствующей развитию ОРДС, сердечной недостаточности, углублению гемодилюционной коагулопатии
вплоть до развития ДВС-синдрома. Изучение частных закономерностей
у больных с ОМИК в разных возрастных группах, с различными сопутствующими
заболеваниями позволило обратить внимание на необходимость определения
формального баланса жидкости и его коррекции в послеоперационном периоде операционных
суток.
Определен необходимый
и достаточный объем ИТТ и ее компонентов в зависимости от объема кровопотери.
Установлено, что с целью профилактики развития острого синдрома ДВС необходима
трансфузия СЗП объемом не менее 30-35% от общего объема ИТТ. Выявлено
оптимальное отношение коллоидных и кристаллоидных
растворов, необходимое для поддержания нормальных значений коллоидно-осмотического
давления в послеоперационном периоде. Последнее положение считаем мерой
профилактики ОРДС наряду с предотвращением гипергидратации.